15支问题注射液在海南已售出使用 暂未收到不良反应报告
有媒体报道称,江苏苏中药业股份有限公司生产的生脉注射液在广东省发生不良事件,个别患者用药后出现寒战、发热症状。经查,江苏苏中药业集团股份有限公司生产的涉事批次生脉注射液批号为14081413,2014年8月14日生产,有效期至2016年8月13日,总计37638支,其中销往海南的有15支。
4月25日下午,记者从海南省食品药品监督管理局获悉,海南某医疗机构购买了江苏苏中药业股份有限公司生产的生脉注射液5盒共15支,药品已经售出使用,但海南省药品不良反应监测中心目前没有收到药品不良反应报告。
此前消息:江苏苏中药业3万多支问题"生脉注射液"流入海南等9省区
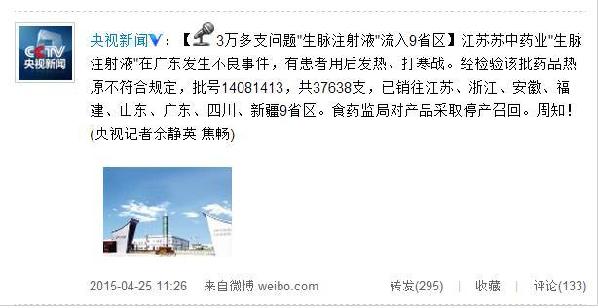
微博截图
近日,江苏苏中药业集团股份有限公司生产的生脉注射液在广东省发生不良事件,个别患者用药后出现寒战、发热症状。经广东省食品药品检验所检验,该批次药品热原不符合规定。江苏省食品药品监督管理局已采取对企业进行现场检查、监督企业暂停该品种生产和销售、召回问题批次药品、彻查药品质量问题原因等措施。同时,组织对该企业同一生产周期相关批次药品进行检验,扩大风险评估范围,发现问题及时处置。
经查,江苏苏中药业集团股份有限公司生产的涉事批次生脉注射液批号为14081413,2014年8月14日生产,有效期至2016年8月13日,总计37638支。共销往江苏(2400支)、浙江(13788支)、安徽(12支)、福建(12支)、山东(417支)、广东(9954支)、海南(15支)、四川(7200支)、新疆(3840支)等9省(区)。
为保障公众用药安全,国家食品药品监督管理总局要求江苏省食品药品监督管理局在做好上述工作的基础上,监督企业采取有效措施,确保问题药品全部召回,并监督销毁;监督企业彻查药品质量问题原因,针对查明的原因进行整改,在未查明原因、未整改到位之前不得恢复生产,恢复生产需报总局备案;对企业存在的违法违规行为依法立案查处。问题药品流入地的省(区)食品药品监督管理部门要密切关注药品流通使用情况,并监督相关企业配合召回问题药品。药品不良反应监测机构要加强监测,发现不良事件及时报告。
总局要求地方各级食品药品监管部门必须以对人民群众高度负责的态度,全面履行监督责任,对药品质量问题绝不放过,对违法违规企业绝不手软。药品生产企业要吸取这一事件的教训,严格药品生产质量管理,严把药品质量关,切实承担起药品安全主体责任。
盘点:近两年出现哪些问题“注射液”?
时间:2015年2月
地点:山东
现象:注射液含类似毛发状异物
通告称,长春市一诊所日前发现山东齐都药业有限公司生产的盐酸左氧氟沙星氯化钠注射液有类似毛发状异物,事发后涉事产品被该公司业务员销毁,但有关证据证明涉事产品确实存在上述问题,山东齐都药业有限公司承认以上事实。
时间:2014年8月
地点:湖北
现象:连续出现23例发热、过敏等严重不良反应
2014年8月12日国家食品药品监督管理总局收到报告,反映湖北同济奔达鄂北制药有限公司生产的核黄素磷酸钠注射液(批号:201311081)在浙江省连续出现23例发热、过敏等严重不良反应。经宁波市药检所检验,该批药品的“无菌、细菌内毒素和可见异物”项不符合规定。
时间:2014年12月
地点:安徽
现象:患者用药后出现寒战、发热症状
经查,2014年下半年在河南省也有个别患者使用该企业生产的胞磷胆碱钠注射液出现寒战、发热的病例报告。经检验,批号为131228的药品“可见异物”项不符合规定。此外,2012年和2013年,该企业生产的胞磷胆碱钠注射液分别各出现一起类似不良事件。
时间:2013年12月
地点:四川
现象:患者用药后出现寒战、发热等不良反应
8月以来,四川升和药业生产的部分批次丹参注射液在多个省份,致多名患者用药后出现寒战、发热等不良事件。目前,企业已全面停产并深入查找原因。
·凡注明来源为“海口网”的所有文字、图片、音视频、美术设计等作品,版权均属海口网所有。未经本网书面授权,不得进行一切形式的下载、转载或建立镜像。
·凡注明为其它来源的信息,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。








f010404c-a7aa-4bd6-8cf4-ad744fe0eb01.jpg)
677d604c-658a-41eb-b0c2-b4a9d1f2a050.jpg)
6987e23d-abc1-43dc-b025-e8b3104147b2_zsize.jpg)






edef585a-fede-4ca8-bfa9-10e036755de3_zsize_watermark.jpg)



